
01
研究背景
在过去的几十年里,手性布朗斯台德酸催化的不对称合成受到了极大的关注,科研人员基于这种方法已经开发出了许多有效的合成方法。然而,手性布朗斯台德酸在这些反应中的应用大多局限于亚胺和羰基的活化,而碳-碳三键的直接活化到目前为止还没有被提及。
02
研究问题
为此,化学系洪鑫与厦门大学叶龙武教授课题组展示了手性布朗斯台德酸能够通过炔烃的直接活化来催化萘酚、苯酚和吡咯酰胺类化合物的不对称脱芳构化反应。该方法实现了各种有价值的螺环烯酮和2H-吡咯的原子经济结构,这些化合物都带有手性的四碳立体中心、产率优良、具有很好的化学选择性、区域选择性和对映体选择性。本研究揭示的手性布朗斯台德酸催化的活化模式有望在涉及氰胺及其相关杂原子取代炔烃的不对称催化反应中得到广泛应用。
03
图文解析

▲图1|手性布朗斯特酸催化的不对称合成。
要点:● 在过去的几十年里,手性布朗斯台德酸催化引起了广泛的关注,并实现了许多有效的非对称的转化。尽管取得了令人印象深刻的进展,但这些无金属的反应在很大程度上仅限于亚胺和羰基的活化(图1a)。除了少数富含电子的烯烃、二烯和无偏的烯烃的活化例子外,手性布朗斯台德酸直接活化未活化的碳-碳多键的研究很少(图1a)。特别是,尽管已经实现了几种通过迈克尔型加成反应的炔烃的不对称反应,但手性布朗斯台德酸对炔烃的直接活化作用到目前为止还没有被提及(图1b)。● 在这里,本文报告了手性布朗斯台德酸催化的萘酚和苯酚酰亚胺的CADA反应的实现,它代表了通过碳-碳三键的直接活化的手性布朗斯台德酸催化(图1c)。这种不含金属的方案能够以实际和原子经济的方式合成多种有价值的螺环烯酮,这些螺环烯带有手性的季碳立体碳化合物、总收率高、对映体选择性高(高达99:1 (e.r.))。此外,该反应还可以扩展到高效地合成多种手性螺环2H-吡咯,因为其对映体选择性很高(高达98:2 (e.r.))。值得注意的是,在各种生物活性分子和天然产物中经常可以观察到这些螺旋环状骨架。
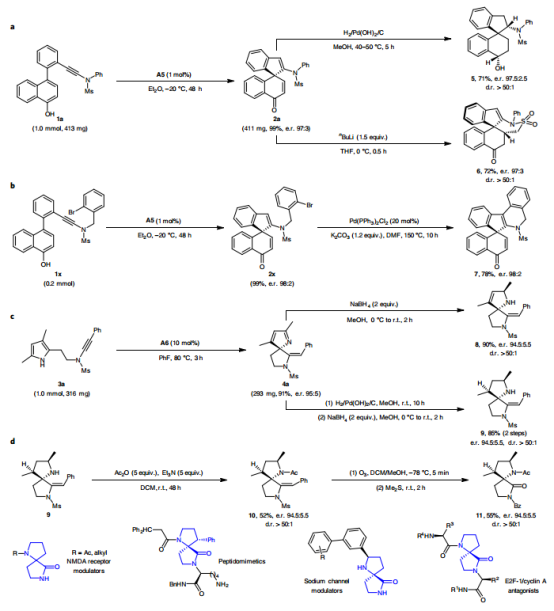
▲图2|制备规模的合成和进一步的转化。
要点:● 本文进一步探索合成的螺环产物的合成转化(图2)。例如,2a的还原可以在制备规模上以99%的产率和e.r.。在氢气情况下,即使只用1mol%的CPA A5作催化剂,Pd(OH)2/C也能以71%的产率合成螺环醇5。有趣的是,用nBuLi处理2a可以通过分子内Michael加成以72%的产率获得相应的磺内酰胺6(图2a)。此外,2x的分子内Heck偶联可以78%的产率生成六环N-杂环7(图2b)。● 此外,本文还对手性螺环2H-吡咯4a进行了进一步的转化。4a的α,β-不饱和亚胺的一部分可以以91%的产率制备。在95:5的条件下,可以用NaBH4选择性地还原,从而以90%的产率得到产品8(图2c)。● 相反,4a的2H-吡咯的C=C和C=N双键都可以通过氢化和NaBH4还原来还原,最终以85%的收率(两步)得到所需的产物9。有趣的是,游离N-H的酰化和臭氧氧化导致螺环γ-内酰胺11以29%的产率(两步)生成,并且这种杂环部分可以在一系列生物活性分子中找到。值得注意的是,mesyl(Ms)基团被BZ基团取代从而参与了这种臭氧氧化过程(图2D)。
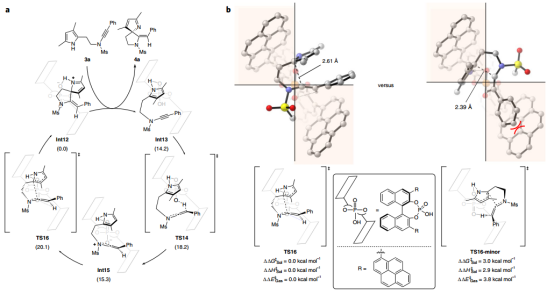
▲图3|催化循环和对映体选择性的密度泛函计算:测定吡咯酰胺类化合物CADA反应的C-C键形成过渡态
要点:● 图3A详细说明了CPA催化机理的自由能变化。产物-CPA复合物Int12释放出的碱性氮杂-螺环产物放热14.2kcal mol-1,从而在T13形成吡咯-CPA复合物。亚硝胺通过过渡态TS14随后的质子化是容易实现并且是可逆的,同时还生成酮亚胺中间体Int15。在Int15中,烯亚胺与磷酸盐之间既存在氢键作用,又存在离子对相互作用。● 图3B展示了C-C键形成过渡态TS16和TS16-Minor。A6催化剂的底物与磷酸盐之间的氢键和离子对相互作用在手性微环境中可以高效地捕获底物,根据本文的计算,竞争过渡态的差值为3.0kcal mol-1。这一结果与观察到的(R,E)-氮杂螺环产物的形成是一致的。通过比较这两个过渡态,发现A6中的空间要求较高的芘取代基占据了第二和第四象限(图3b)。
04
结语
洪鑫与叶龙武课题组所描述的方法使手性布朗斯台德酸能够通过直接活化炔酰胺来实现萘酚、苯酚和吡咯-炔酰胺的CADA反应,这表明了通过碳-碳三键直接活化的手性布朗斯台德酸催化反应是可以实现的。在手性布朗斯台德酸的催化反应中,手性布朗斯台德酸通过碳-碳三键的直接活化表明了手性布朗斯台德酸的催化作用。该方法在温和的反应条件下提供了一种实用的、原子经济的方法来获得一系列有价值的螺环烯酮和2H-吡咯。特别地,使用该策略的反应表现出良好的多重选择性,包括化学选择性、区域选择性和对映体选择性,从而有望在有机化学和药物化学中得到应用。此外,理论计算进一步证明了该布朗斯台德酸催化剂的活化方式和对映体选择性的来源。本文认为,这种独特的活化模式为进一步探索手性布朗斯台德酸催化的杂原子取代炔烃反应和不对称氰化化学奠定了基础。
原文链接:https://www.nature.com/articles/s41557-021-00778-z
05
作者简介

洪鑫(化学前瞻技术研究中心PI)
洪鑫,浙江大学百人计划研究员,博士生导师。2006-2010,中国科技大学,本科,化学,导师:傅尧教授;2010-2014,加州大学洛杉矶分校,博士,有机化学,导师:Kendall N. Houk(美国科学院院士,世界上研究物理有机化学最著名的几位学者之一);2014-2015,加州大学洛杉矶分校,博士后,导师:Kendall N. Houk 。2015-2016,斯坦福大学,博士后,导师:Jens K. Norskov(美国工程院外籍院士,世界上研究异相催化化学机理和催化剂设计最著名的几位学者之一)。
研究方向:计算有机化学;物理有机化学;机器学习在化学反应预测中的应用;反应机理研究。
